第38回 ウイルスどうしを戦わせて感染症を克服する
1.はじめに
最近、遺伝子ドライブという現象を用いて、ウイルスどうしを戦わせ、有害なウイルスを根絶させるという方法が研究されてきている。今回はこれについて紹介する。
2.研究の背景
(1)不妊虫放飼法
ウイルスどうしを戦わせるという発想は、有害な昆虫を撲滅するために考案された「不妊虫放飼法」という手法にヒントを得ていると思われる。
それは、まず昆虫の雄に放射線を当てて生殖能力を失わせる。その上でその不妊化した雄を、野外に大量に繰り返して放出する。すると、放出された不妊化雄は野生型の雌と交尾するが、子はできない。その分、野生型の昆虫どうしの交尾の機会は減る。そうして、世代とともに野生型の昆虫は減っていき、そのうち絶滅する。
つまり、野生型と不妊型を競合させて、じわりじわりと野生型の数を減らしていくのである。この手法を利用して、日本ではかつて沖縄で繁殖していたウリミバエを絶滅させることに成功した。
(2)遺伝子ドライブ
この不妊虫放飼法はずいぶん昔(1930年代)からある技術だが、原理的には不妊化のために放射線を使わず、遺伝子操作を行って不妊の雄を作出し、それを野外に放つという方法でもよいはずである。
ただ、そうして作られた遺伝子操作した不妊化雄は子孫を作らないため、放出用に増やして大量に用意することができず、野生型と競合させることができない。
しかし、そんな中、遺伝子操作手法で有効な手法ができつつある。それは、ゲノム編集技術を用いて作出した個体に起こる遺伝子ドライブという現象を用いるものである。
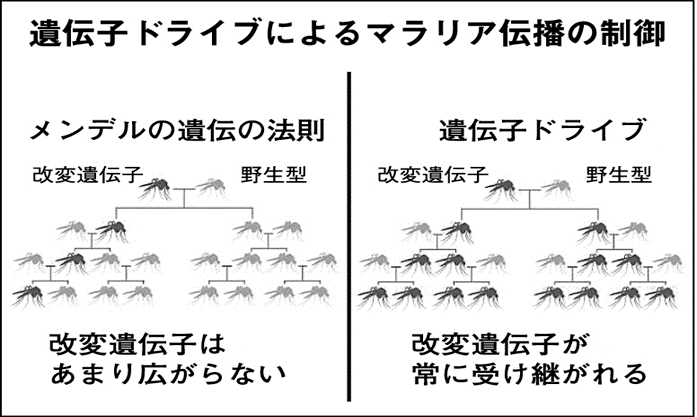
上の図の左半分を見ていただきたい。高等生物の染色体は、父親由来と母親由来が1本ずつ含まれており、それが子に伝わる可能性はそれぞれ50%である。
このため、メンデルの法則に従うと、一般的な遺伝子操作技術を用いて改変した遺伝子は、野生型と有性生殖すなわち交配を繰り返しても、そのうち一部にしか伝わっていかない。
そこで、前述のように従来法で野生型を撲滅するためには、大量の不妊化雄を、しかも何度も繰り返して放出することにより、不妊化雄と交接した雌を不妊にして子孫を作れないようにするしかない。
だが、遺伝子編集をした生物に起こる遺伝子ドライブという現象によると、図の右半分のように、改変した遺伝子が、有性生殖によってできた子孫のかなりの割合に伝わっていくのである。
この原理はよく分かっていないところもあるが、ゲノム編集CRISPR/Cas9を用いて導入した遺伝子や変異が有性生殖を行った際、導入した染色体だけでなく、相同染色体にも連鎖的に起こることにより生じる。
こうなれば、大量・繰り返しの放出による不妊化による競合を起こさなくても、無害な個体を一匹導入するだけで、何世代かのうちに野生型全体が無害のものに変わるというわけである。
現在、この方法を用いて、蚊のDNAに「死に至る遺伝子」を埋め込み、蚊の個体群を全滅させる試みがなされている。
(3)ウイルスでの遺伝子ドライブ
では、それと同じことがウイルスでできるだろうか。つまり、遺伝子ドライブの仕組みにより、無害なウイルスにより有害なウイルスを駆逐していくことができるか否か。
一般的にはそれは難しい。ウイルスはそもそも有性生殖生物ではない。ウイルスは単に感染した細胞の仕組みを使って自分の遺伝子を読み込ませ、新しいウイルスを複製していくだけである。複製時、互いの遺伝子を交換するようなことはない。
しかし、ヘルペスウイルスの場合、複数のウイルスが一つの細胞に感染すると、細胞中で遺伝子の配列をランダムに組み換えるという、有性生殖に似たことがしばしば起こる。このプロセスを用いて、最終的にはウイルス集団全体を無力化するような遺伝子変異を導入するということが考えられる。
ヘルペスウイルスの仲間には、単純ヘルペスウイルス(HSV-1、HSV-2)のほか、ヒトサイトメガロウイルス(hCMV)、エプスタイン・バーウイルス等がある。
これらヘルペスウイルスは、感染すると生涯にわたって宿主に潜伏する。そして何らかのきっかけで再活性化し、症候性疾患を引き起こす。再活性化は薬剤によって抑えることができるが、免疫系が低下している人の場合、薬剤が効かないことが多い。
そして再活性化は多くの臓器に影響を与え、死に至ることさえある。それゆえ、遺伝子ドライブの現象を利用できれば大きな医療の進展につながる。
3.研究の成果
ウイルスへの遺伝子ドライブの適用の可能性については、2020年、米国のバック老化研究所の研究者らが実証し、Nature Communication誌に報告している。
彼らは細胞培養実験により、CRISPR/Cas9遺伝子を組み込んだhCMVが、感染細胞内にいる他のhCMVに、遺伝子ドライブとしてCRISPR/Cas9遺伝子そのものを伝播することができることを示した。
CRISPR/Cas9は、ヌクレアーゼと呼ばれるDNA切断酵素と、同酵素をウイルスゲノム内の特定の場所に誘導するガイドRNAからなっている。
研究者らはウイルスにCRISPR/Cas9遺伝子を組み込み、CRISPR/Cas9遺伝子自体のところで切り出して、他のウイルスに挿入されるようにした。さらに、この複合体に蛍光マーカーの遺伝子をつないでおくことで、遺伝子ドライブによって他のヘルペスウイルスに拡散していく様子を発光で追跡できるようにした。
なおこの実験では、CRISPR/Cas9遺伝子はウイルスを免疫攻撃から守る防御タンパク質の位置に組み込まれていたため、防御タンパク質の量が低下し、ウイルスがより脆弱になった。
ただし、この論文はあまり注目を集めなかった。そして、遺伝子ドライブ因子が野生型ウイルスに広がっていくためには、改変型ウイルスと野生型ウイルスが同一細胞内に共存する必要があるが、そのような環境を作り出せる培養細胞ではともかく、生体内ではそのような現象は起きないだろうという批判もなされた。
しかし、2023年12月、米国フレッドハッチがんセンター(FHCC)に移動した研究者の1人は、オープンジャーナルであるbioRxiv誌へ投稿し、培養細胞ではなく実験動物のマウスにおいて、HSV-1遺伝子ドライブが伝播することを示したのである。
彼らは、遺伝子修飾を行ったHSV-1と、野生型のHSV-1を同時にマウスに投与し、一定期間の後に各器官にどのような割合でウイルスが存在しているか調べた。実際には、組み込んだ蛍光マーカー遺伝子により、HSV-1遺伝子の伝播速度はマウスの体の各部位で異なっていることが分かった。たとえば大脳皮質ではウイルスの25%に伝播したに過ぎなかったが、脳幹では90%にも伝播した。90%の比率であれば、HSV-1感染による痛みを伴うヘルペスなどの症状の発生を防ぐに十分である。
また、2023年12月、中国の南方医科大学の論文もbioRxiv誌に投稿された。これは、Casのうち、Cas12f1をベースとする遺伝子ドライブの方が、変換率と耐性が高いこと、またHSV-1の遺伝子ドライブは、hCMVよりも速いスピードで着実に広がることも示した。
4.おわりに
遺伝子ドライブを用いたウイルスの撲滅法は、このように一定の成果が出てきているが、ヒトでの実用化にはまだまだ程遠いとされる。
ウイルスを撲滅するために、どのような遺伝子をどのように改変したらよいか、正確に解明されていない。有性生殖でいう不妊にはならなくても、有害にならないような改変を行わねばならない。
もし遺伝子ドライブが標的とするウイルスを十分に弱めなければ、改変されたウイルス自体が病気を引き起こす可能性がある。特に免疫に障害のある人々はその可能性が大きい。
また、改変されたウイルスが野生型に戻ったり、増強される可能性を完全にゼロにしなければならない。
さらに、たとえそれらの問題を克服したとしても、増殖していくウイルスを人体に接種したり屋外に放出したりすることに対する心理的抵抗感は少なくないと思われる。
研究者らは、今後、動物モデルでの実験を計画しており、遺伝子ドライブが慢性HSV-1感染を十分に抑制し、再活性化と発病を防ぐことができるかどうかを解明したいと考えている。そのような各種の研究を進めていった先に、ウイルスの撲滅が視野に入ってくることを期待したい。
参考文献
・J. Cohen (2023) “ ‘Gene drive’ may help fight viruses with viruses”, Science; Vol.382, 1337-1338
・「遺伝子ドライブで、ウイルス感染症を抑え込めるか?」crisp_guide(2023/12/27)(https://crisp-bio.blog.jp/archives/34415905.html)
・「科学技術は私達の生活にどのように関わってくるのか ゲノム問題検討会議のシンポより」長周新聞(2019/9/3)(https://www.chosyu-journal.jp/shakai/12973)
ライフサイエンス振興財団嘱託研究員 佐藤真輔

